Wenn der pH entscheidet: Neue Einblicke in mRNA-Nanopartikel
Lipidnanopartikel (LNPs) sind winzige Fettpartikel, die in modernen mRNA-Impfstoffen als Transporthüllen dienen. Sie schützen die empfindliche mRNA und sorgen dafür, dass sie zuverlässig in die Zielzellen gelangt. Entscheidend für diese Funktion ist der pH-Wert: Je nach Umgebung – etwa im Blut oder im Inneren der Zelle – verändert sich die elektrische Ladung bestimmter Lipide in den Nanopartikeln und steuert so Aufnahme und Freisetzung der mRNA. FAU-Forschende konnten nun erstmals zeigen, wie diese pH-abhängigen Eigenschaften von der Zusammensetzung der Nanopartikel beeinflusst werden. Die Ergebnisse wurden jetzt in der renommierten Fachzeitschrift Small veröffentlicht.
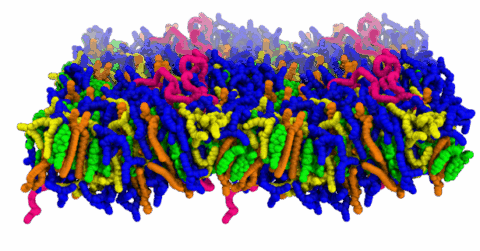
Im Zentrum der Studie stehen sogenannte ionisierbare Aminolipide – spezielle Fettmoleküle, deren elektrische Ladung sich abhängig vom pH-Wert ändert. Diese Eigenschaft ist entscheidend dafür, dass LNPs ihre Fracht im richtigen Moment freisetzen können. Mithilfe von Moleküldynamik-Simulationen, die mit Unterstützung des Zentrums für Nationales Hochleistungsrechnen Erlangen (NHR@FAU) durchgeführt wurden, untersuchten die Forschenden systematisch, wie der pKₐ-Wert dieser Lipide von ihrer Umgebung abhängt. Der pKₐ-Wert beschreibt dabei den pH-Punkt, an dem ein Molekül seine elektrische Ladung ändert – und damit gewissermaßen den „Schaltpunkt“, bei dem die Lipide von ungeladen zu geladen wechseln.
DOI: http://doi.org/10.1002/smll.202511381
Das Video zeigt die pH-abhängige Umorganisation der Membranstruktur bei einer Erhöhung des pH-Wertes von 5 (sauer, Zustand zu Beginn des Videos) auf pH 7 (neutral). Positiv geladene Aminolipide sind blau dargestellt, ungeladene Aminolipide gelb, Cholesterin grün.